Neuroimaging-유성혜 교수
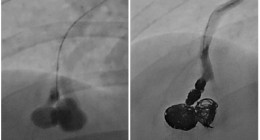
Neurointervention-백성현 교수
Thoracic Imaging-황성호 교수
Cardiovascular Imaging-이종민 교수
Breast Imaging-김민정 교수
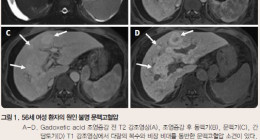
Abdominal Imaging-이승수 교수
Abdominal Imaging-강효진 교수
Urogenital Imaging-나성은 교수, 김승협 명예교수
Intervention-권동일 교수
Musculoskeletal Imaging-차장규 교수
Pediatric Imaging-이미정 교수
2026 1월 국제학회일정
2026 2월 국제학회일정
2026 3월 국제학회일정
| SUN | MON | TUE | WED | THU | FRI | SAT |
|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| 15 | 16 | 17 | 18 | 19 | 20 | 21 |
| 22 | 23 | 24 | 25 | 26 | 27 | 28 |
| 29 | 30 | 31 |
| 일정제목 | 날짜 |
| SSR 2024 (Society of Skeletal Radiology) | 03/02/2024 ~ 03/06/2024 |
| SIR 2024 (Society of Interventional Radiology) | 03/23/2024 ~ 03/28/2024 |
| SSR 2024 (Society of Skeletal Radiology) | 03/02/2024 ~ 03/06/2024 |
| SSR 2024 (Society of Skeletal Radiology | 03/02/2024 ~ 03/06/2024 |
| SIR 2024 (Society of Interventional Radiology) | 03/23/2024 ~ 03/28/2024 |
| UltraCon 2025 (American Institute of Ultrasound in Medicine) | 03/29/2024 ~ 04/02/2024 |
| STR 2025 (Society of Thoracic Radiology) | 03/01/2024 ~ 03/05/2024 |
| SIR 2025 (Society of Interventional Radiology) | 03/29/2024 ~ 04/02/2024 |
| SSR 2025 (Society of Skeletal Radiology) | 03/30/2024 ~ 04/02/2024 |
| UltraCon 2025 (American Institute of Ultrasound in Medicine) | 03/29/2025 ~ 04/01/2025 |
| STR 2025 (Society of Thoracic Radiology) | 03/01/2025 ~ 03/05/2025 |
| SIR 2025 (Society of Interventional Radiology) | 03/29/2025 ~ 04/02/2025 |
| SSR 2025 (Society of Skeletal Radiology) | 03/30/2025 ~ 04/02/2025 |

 서울시 강남구 논현로72길 29, 3층 메디칼업저버 / TEL : 02) 3467-5482
서울시 강남구 논현로72길 29, 3층 메디칼업저버 / TEL : 02) 3467-5482
Copyright © Radiology Digest All rights reserved.
